حساب طاقة الإلكترون في المدار رقم ( ن ) وفقاً لنظرية بوهر
حساب طاقة الإلكترون في المستويات لذرة الهيدروجين
........(7)
وطاقته في المدار الأول من أجل ن=1 وهو أدنى مستوى طاقة له هي :
وبالتعويض عن قيم الثوابت في العلاقة (8) نجد أن قيمة طا1 = -2.17 × 10-18 جول
وبعد تحويلها إلى (إ.ف) نجد أن : طا1 = -13.6 إلكترون فولت (إ.ف) , حيث واحد إلكترون فولت (1 إ.ف) = 1.6 × 10-19 جول
*ـ الإشارة السالبة في العلاقة (7) تعني , وفقاً للميكانيكا التقليدية , أن الإلكترون مرتبط بالنواة وذلك برسم مدار حولها .
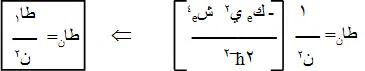
*ـ يمكن كتابة العلاقة (7) بدلالة العلاقة (8) كالآتي :
وبالتعويض عن قيم الثوابت في العلاقة (8) نجد أن قيمة طا1 = -2.17 × 10-18 جول
وبعد تحويلها إلى (إ.ف) نجد أن : طا1 = -13.6 إلكترون فولت (إ.ف) , حيث واحد إلكترون فولت (1 إ.ف) = 1.6 × 10-19 جول
*ـ الإشارة السالبة في العلاقة (7) تعني , وفقاً للميكانيكا التقليدية , أن الإلكترون مرتبط بالنواة وذلك برسم مدار حولها .
*ـ يمكن كتابة العلاقة (7) بدلالة العلاقة (8) كالآتي :
...... ( 9 )
وبإعطاء (ن) القيم 1 , 2 , 3 , 4 , .......∞ نجد أن طاقات الإلكترون في المدارات (المستويات) المناظرة هي:
وقيمها على التوالي : ( -13.6 ) , ( -3.4 ) , ( -1.51 ) , ( -0.85 ) ...........(صفر) إلكترون فولت (إ.ف) . انظر الشكل (19)
*ـ هذه الطاقات هي الطاقات المسموحة التي يمكن للإلكترون أن يأخذها في داخل الذرة وليس أية طاقة ,
*ـ فهي إذن على شكل كمات أو زخات من الطاقة وليست قيماً متصلة ، ولهذا يقال إن طاقات الإلكترون داخل الذرة هي طاقات مكممة.
*ـ والعدد (ن) هو العدد الذي يتحكم في إعطاء هذه الكمات من الطاقة لهذا سمي بالعدد الكمي الرئيسي .
س :علل : طاقة الإلكترون(طان) في أي مستوى تتناسب تناسباً طردياً مع العدد الكمي الرئيسي (ن) ،رغم أن
*************************************************
شرح بالفيديو لـ حساب طاقة الإلكترون في المستويات لذرة الهيدروجين